
2020.4.6
湖北WTO/TBT通报咨询中心
目录
一.欧盟标准和认证程序
二.美国标准和认证程序
三.日本标准和认证程序
四.韩国标准和认证程序
五.澳大利亚标准和认证程序
六.东盟口罩标准与认证
七.非洲口罩标准与认证
八.各国防护口罩标准指标比对
九.我国防护口罩标准指标比对
一.欧盟标准和认证程序
非医用口罩标准
EN 149:2001+A1呼吸保护装置.防微粒过滤半面罩.要求 试验、标记
颗粒物过滤指标

医用口罩标准
EN 14683-2019 医用口罩.要求和试验方法 主要性能指标
细菌过滤效率指标

防液体喷溅指标

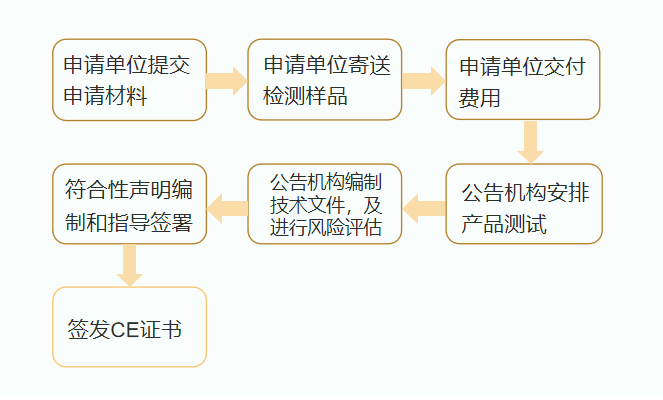
CE认证流程
医用口罩
需按照欧盟医疗器械指令93/42/EEC(MDD)或欧盟医疗器械条例EU2017/745(MDR)加贴CE标志,对应的标准是EN14683。根据口罩产品无菌或非无菌状态,采取的合格评定模式也不同。
(1)无菌医用口罩:必须由授权公告机构进行CE认证。
(2)非无菌医用口罩:企业只需进行CE自我符合性声明,不需要通过公告机构认证。在准备好相应文件及测试报告等资料后,即可自行完成符合性声明。
个人防护口罩
个人防护口罩不属于医疗器械,但需符合欧盟个人防护设备条例EU2016/425(PPE)要求,由授权公告机构进行CE认证并颁发证书,对应的标准是EN149。
不同认证机构流程略有不同,大致流程如下:
CE认证机构
1.欧盟医疗器械指令93/42/EEC(MDD)授权的公告机构查询地址:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=13
2.欧盟医疗器械条例EU 2017/745(MDR)授权的公告机构查询地址:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=34
3.欧盟个人防护装备条例EU2016/425(PPE)授权的公告机构查询地址:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=155501
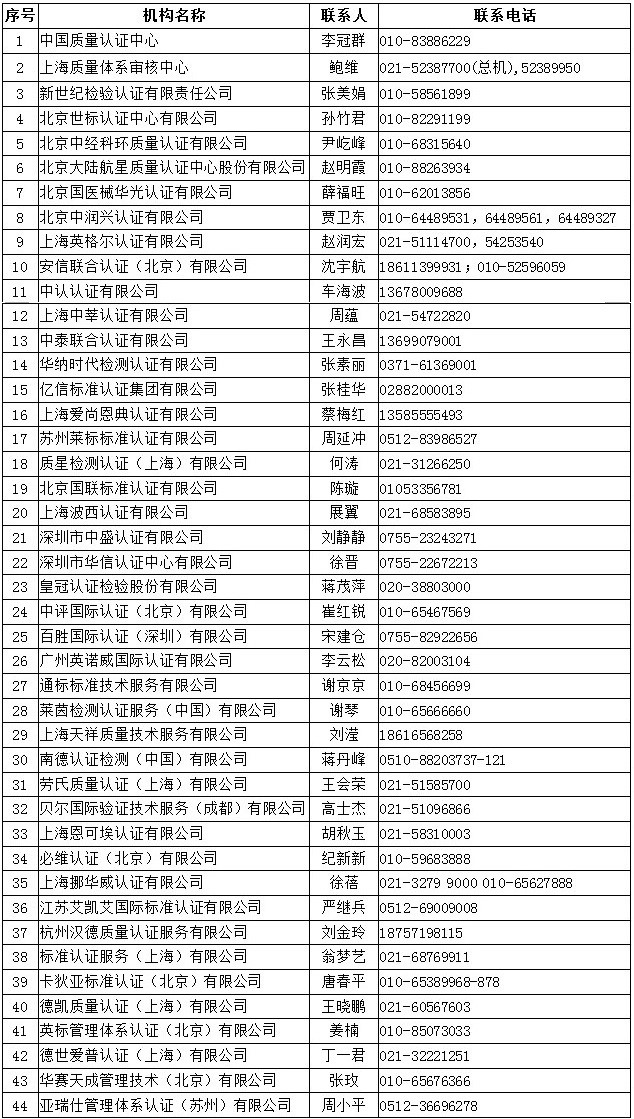
中国境内具有口罩等防疫用品CE认证能力的认证机构如下:

国境内可以开展医疗器械管理体系(ISO13485)认证的机构如下:
CE认证变化
2020年5月26日, MDR指令在欧盟就将开始强制执行
根据目前欧盟最新统计,拥有老指令版本MDD(93/42/EEC)授权的NB公告机构共有56家,而符合MDR授权的NB公告机构目前则仅有12家而已。也就是说,从2020年5月26日开始,针对医用口罩的CE认证审核机构可选性降低了80%; 认证周期必然大幅度拉长,本次疫情期间有些机构声称的几天出证的可能性将基本为零;
BSI的CE快速认证
为应对新冠疫情,英国标准协会(BSI)在响应欧盟额委员会在对产品CE认证谨慎把关的前提下,开启CE认证快速通道,用于疫情期间供医务人员所使用的PPE口罩的CE认证。该快速认证服务可以让整个认证周期缩短至3周左右。
快速认证方案 - 01
● 申请条件 ●
制造商持有NIOSH N95/N100或AS/NZS 1716:2012报告
● 可选认证模式 ●
Module B + Module C2 或
Module B + Module D
● 要点[1] ●
测试报告须出自北美,欧洲,澳洲新西兰的ISO 17025认可实验室
对于Module C2模式的执行,可先发Module C2证书,并在发证后执行Module C2随机抽样测试检查
Module D模式执行制造商质量体系审核,合格后颁发Module D证书
快速认证方案 - 02
● 申请条件 ●
制造商持有GB 2626-2006测试报告和BSI EN 149技术规范中项目的测试报告
● 可选认证模式 ●
Module B + Module C2
● 要点[1] ●
测试报告都须出自CNAS认可实验室
对于Module C2模式的执行,可先发证书,但须在Module B证书颁发后执行Module C2随机抽样测试检查
快速认证方案 - 03
● 申请条件 ●
制造商持有GB 2626-2006测试报告
● 可选认证模式 ●
Module B + Module C2
● 要点[1] ●
测试报告都须出自CNAS认可实验室
对于Module C2模式的执行,可先发证书,但须在Module B证书颁发后执行Module C2随机抽样测试检查,并进行EN 149指定项目测试
快速认证方案 - 04
● 申请条件 ●
制造商持有非上述标准或技术规范的测试报告或不持有任何测试报告
● 可选认证模式 ●
Module B + Module C2
● 要点[1] ●
须根据BSI的 EN 149技术规范进行测试
对于Module C2模式的执行,可先发证书,但须在Module B证书颁发后的6个月内执行Module C2随机抽样测试检查
二.美国标准和认证程序
呼吸防护口罩
42 CFR Part 84 呼吸保护设备的批准
颗粒过滤效率指标

医用口罩
ASTM F2100-2019 医用口罩用材料性能的标准规范
颗粒过滤指标

细菌过滤效率

认证程序
个人防护口罩
个人防护口罩需通过NIOSH注册,企业直接在NIOSH官网申请。按照NIOSH认证标准,企业需寄送样品至NIOSH实验室实施测试,同时提交技术性资料(包括质量体系部分资料)至NIOSH文审,文审和测试都通过后,NIOSH核发批文
医用口罩
美国医用N95 医用口罩需通过FDA注册,企业直接向FDA官网申请并提交相关材料。
此外还有两种可选途径:
(1)已经获得NIOSH注册的N95口罩,在产品生物学测试、阻燃测试和血液穿透测试通过的情况下,可以豁免产品上市登记(510K),直接进行FDA工厂注册和医疗器械列名。
(2)如果获得持有510K的制造商的授权,可以作为其代工厂使用其510K批准号进行企业注册和器械列名。
“510(k)”又称上市前登记,是向FDA提交的上市前报告。根据FDA的要求,少数 I 类和大部分II类医疗器械在美国上市前,至少需要提前90天递交510(k)申请
FDA510(k)认证费用:
2020年 FDA510(k)使用费
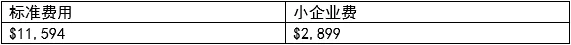
公司注册年费:5236美元。
对于小型机构、企业或团体,没有豁免或减免——所有机构都必须支付机构注册费
认证变化
3月28日,美国食品药品管理局FDA又推出了一个新的“紧急使用管理”(Emergency-Use-Administration, 简称EUA),FDA紧急批准了获得了五个国家和欧盟认证的非N95口罩,中国的KN95口罩却不在名单内。
美国接受澳大利亚、巴西、欧盟、日本、韩国、墨西哥本国或地区N95级别的标准,中国的口罩一定要达到NOISH-N95的标准和认证才能在美国使用。
咨询服务机构
UL公司
Tel: 0512-68086400
E-mail: customerservice.cn@ul.com
三.日本标准和认证程序
非医用口罩标准
JIS T 8151:2018 防颗粒呼吸器
颗粒过滤效率指标

医用口罩标准
ASTM F2100-19 医用口罩材料技术规范
性能指标

认证程序
日本PMDA注册
PMDA(药品和医疗设备代理机构)是日本的监管机构,与厚生劳动省合作。
职责是通过确保药品和医疗设备的安全性,功效和质量来保护公众健康。该机构负责对药品和医疗器械的上市授权申请进行科学审查,监控其上市后的安全性,以及为药物不良反应和药物或生物制品感染的患者提供救济补偿。
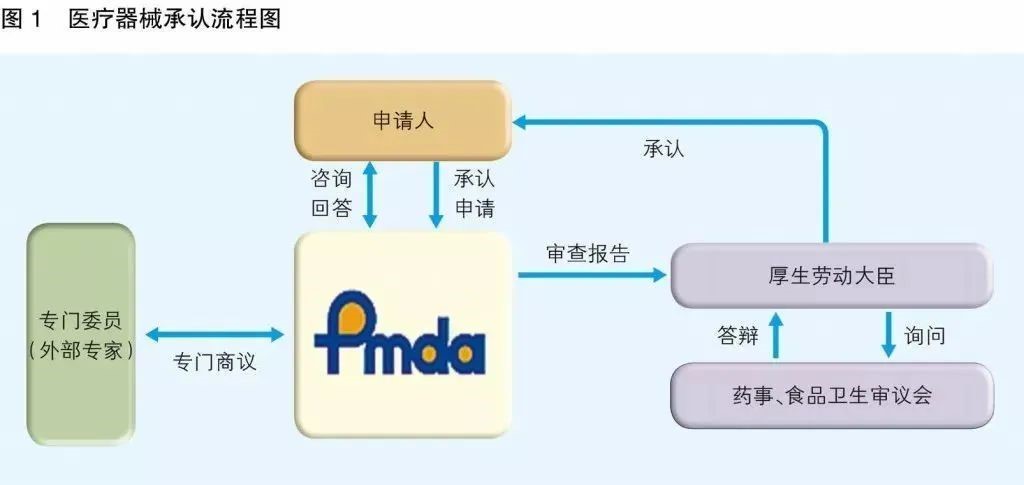
1. 准备阶段。确定产品分类(I,II特殊控制,II类控制,III,IV)和产品JMDN编码,选择MAH(日本持证方);
2. 制造商向PMDA注册工厂;
3. II类特殊控制产品向授权认证机构PCB申请QMS工厂审核,其他II类产品和III类IV类产品向PMDA申请QMS工厂审核,并获得QMS证书;
4. 申请Pre-Market Apporval证书,II类特殊控制由PCB发证,其他II类产品和III类IV类产品控制由MHLW(厚生劳动省)发证;
5. 支付申请费用;
6. 注册文件整改,注册批准;
7. 所有类别产品均需要MAH向RBHW(厚生省地区机构)进行进口通报注册后才能进口销售。
四.韩国标准和认证程序
非医用口罩标准
KS M 6673:2008 防颗粒呼吸器
颗粒过滤效率指标
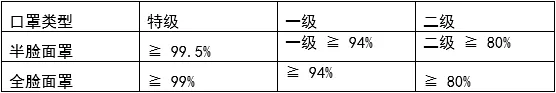
呼吸器标准
法规 MFDS notice No.2015-69
颗粒过滤效率指标

认证程序
韩国医疗器械准入的法规门槛,基本分类为I、II、III、IV类,持证为韩国公司(License holder),韩国收货人需要到韩国药监局Korea Pharmaceutical Traders Association. 提前备案进口资质(没有不行)网址、www.kpta.or.kr。
韩国卫生福利部(MinistryofHealthandWelfare,MHW),简称卫生部,主要负责管食品、药品、化妆品和医疗器械的管理,是最主要的卫生保健部门。依照《医疗器械法》,韩国卫生福利部下属的食品药品安全部负责对医疗器械的监管工作。
KFDA注册流程为:
1. 确定产品分类(I,II,III,IV),选择KLH(韩国持证方);
2. II类产品需申请KGMP证书和接受现场审核,II类产品一般是授权的第三方审核员,并获得KGMP证书;
3. II类产品需要送样品到韩国MFDS授权的实验室进行韩国标准的测试;
4. 由KLH向MFDS(韩国食品药品安全部)提交技术文件(检测报告,KGMP证书等),进行注册审批;
5. 支付申请费用;
6. 注册文件整改,注册批准;
7. 指定韩国代理商和经销商,产品销售
五.澳大利亚标准和认证程序
非医用口罩标准
AS/NZ 1716:2012 防颗粒呼吸器
颗粒效率过滤指标

医用口罩标准
AS 4381:2015 一次性医用口罩
性能指标

认证程序
通过澳大利亚TGA注册,符合AS/NZS 1716:2012标准,此标准是澳大利亚和新西兰的呼吸保护装置标准。
TGA是Therapeutic Goods Administration的简写,全称是医疗用品管理局,它是澳大利亚的医疗用品(包括药物、医疗器械、基因科技和血液制品)的监督机构。澳大利亚对医疗器械分为I类,Is and Im, IIa, IIb, III类,产品的分类几乎和欧盟分类一致,如果产品已经获得CE标志,则产品类别可以按照CE分类。
六.东盟口罩标准与认证
口罩标准
泰国
TIS 2424-2562 一次性使用口罩
颗粒效率过滤指标

细菌过滤效率指标

合成血液穿透

马来西亚
MS 2323:2010呼吸保护装置—防颗粒物过滤半面罩-要求、测试和标志(等同采用欧洲标准EN 149:2001)
颗粒效率过滤指标

印度尼西亚
SNI8488:2018医用口罩材料性能的标准规范
颗粒效率过滤指标

细菌过滤效率指标

合成血液穿透

越南
TCVN 8389-1:2010 医用口罩 第1部分:普通医用口罩
颗粒效率过滤指标
≥90%
TCVN 8389-2:2010医用口罩 第2部分:抗菌医用口罩
颗粒效率过滤指标
≥90%
细菌过滤效率指标
通过医用口罩入侵细菌数量:不得检出
口罩认证
东南亚国家目前主要由海关对进口产品按照当地标准要求进行抽检。
泰国TIS 2424-2562对口罩的细菌过滤效率、压力差、颗粒过滤效率、合成血液不渗透性以及阻燃性能按照美国标准ASTM F2100的检测方法进行检测。在结构方面,口罩的中间过滤层是无纺布,外层和里层有多种形状,如褶皱形、袋装形或鸭嘴形,或单层过滤型,如碗形和附带配件型。
马来西亚口罩相关的国家标准MS 2323:2010《呼吸保护装置—防颗粒物过滤半面罩-要求、测试和标志》等同采用欧洲标准EN 149:2001。该标准规定了过滤半面罩作为呼吸保护装置过滤颗粒物的最低要求,逃生目的的面罩除外。根据EN 132《呼吸保护装置-术语和象形图的定义》,过滤半面罩的整个呼吸保护装置或者大部分由过滤材料制成。颗粒物过滤半面罩能覆盖口、鼻和下颌,可能有吸气阀、呼气阀;能阻隔固体和液体气溶胶。
印度尼西亚国家标准SNI8488:2018《医用口罩材料性能的标准规范》等同采用美国标准ASTM F2100-11《医用口罩材料性能的标准规范》。该标准规定了医疗服务(如外科手术或病人护理)用医用口罩材料的试验和要求,对医用口罩材料性能进行分类。医用口罩材料的性能主要基于细菌过滤效率、压力差、微粒过滤效率、合成血液不浸透性和阻燃性能。该标准规范不包括医用口罩设计和性能的所有方面,不具体评估医用口罩有关阻隔性和透气性的效率,例如面部贴合性的设计等等,也不适用于医疗服务可能需要的呼吸系统保护。
越南的医用口罩标准为TCVN 8389,包括3部分,分别是TCVN 8389-1:2010 《医用口罩 第1部分:普通医用口罩》、TCVN 8389-2:2010《医用口罩 第2部分:抗菌医用口罩》、TCVN 8389-3:2010《医用口罩 第3部分:化学防毒医用口罩》。其中,TCVN8389-1:2010规定的口罩为普通医用口罩,TCVN8389-2:2010规定的口罩适用于抗菌医用口罩,包含具有抗菌作用的纳米银织物层,能阻隔口罩表面99.9%的细菌,TCVN 8389-3:2010规定的口罩主要通过活性炭层过滤有毒蒸汽和有毒气体,因此TCVN 8389-3:2010不在本次防疫用防护口罩范围内。
七.非洲口罩标准与认证
口罩标准
对于标准,肯尼亚、坦桑尼亚、尼日利亚并未对普通口罩作出明确要求。根据目的港的要求,口罩的标准使用依次为国际标准(ISO、IEC)(含先进国家标准,如EN、JIS、ASTM等)、国家标准。
口罩认证与注册
出口非洲的口罩,只能是普通口罩,例如工业的防尘口罩、纸口罩、口罩原料纱布等等。CE认证等有效。
八.各国防护口罩标准指标比对

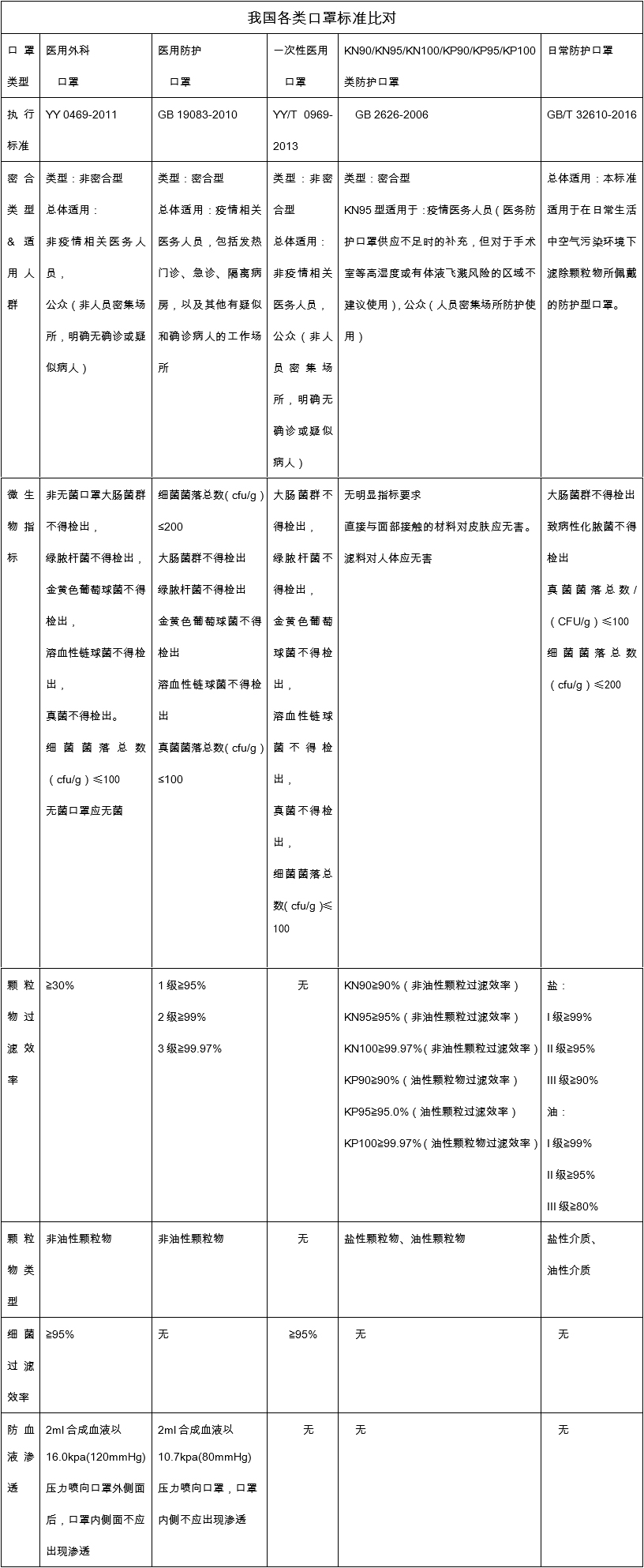
九.我国防护口罩标准指标比对
湖北WTO/TBT通报咨询中心
湖北WTO/TBT通报咨询中心是2007年经省编办批准成立的公益性组织,主要承担我省作为世贸组织地方联络点的职能,收集和通报国际技术性贸易措施信息,结合省情开展国外技术法规体系、标准体系、合格评定措施的专题研究,为外贸进出口提供信息保障。
中心成立以来,持续追踪收集有关WTO成员国正在制定或者新实施的对湖北产品出口可能产生影响的技术性贸易措施(TBT)和卫生与植物检疫措施(SPS)通报,并在官网http://hbsqi.com/officialWebFront#/wto 上及时更新,开放给社会公众浏览。中心每年分几个批次,将省内企业、专家对WTO成员国正在制定或新实施的技术性贸易措施提出的质疑,整理形成评议意见,并把意见提交到中国WTO/TBT国家咨询中心,作为国家有关部委与WTO/TBT和WTO/SPS其它成员国代表谈判,制订我国应对国外技术性贸易壁垒政策的重要参考,并以此维护湖北进出口贸易利益。
中心联系电话:027-88224504
中心邮箱:hubeiwto@126.com
中心地址:湖北省武汉市光谷金融港B27栋3楼
中心官网:http://hbsqi.com/officialWebFront#/wto


鄂公网安备 42010202002607号